xken health
Diagnosi precoce e medicina personalizzata delle malattie croniche, comprese quelle oncologiche, attraverso l’analisi proteomica delle urine, che rappresentano il filtrato del sangue.
- senza rischi - indolore - affidabile -

Malattie croniche
Il radicale cambiamento di paradigma che ha portato alla definizione definitiva delle malattie croniche a livello molecolare, consentendo così una diagnosi precoce e l’assegnazione di farmaci efficaci a ogni singolo paziente, ha spinto la Commissione Europea a identificare la proteomica come la tecnologia chiave con la più alta rilevanza di mercato tra le 13.000 innovazioni finanziate [1].
Dal 2002 sono stati condotti oltre 100 studi clinici, che hanno coinvolto 1.200 medici e scienziati di spicco provenienti da oltre 95 ospedali universitari in tutto il mondo. I risultati sono stati pubblicati in oltre 450 articoli su rinomate riviste scientifiche e rappresentano lo stato attuale delle conoscenze mediche.
L'ONU identifica le malattie croniche come una piaga della civiltà occidentale e le pone sullo stesso livello di minaccia dell'Ebola [3]. La causa è la loro diagnosi tardiva. Attualmente, queste malattie non vengono riconosciute a livello molecolare, dove hanno origine, ma solo sulla base di un massiccio deterioramento funzionale dell'organo interessato. Tuttavia, le malattie si manifestano solo a livello molecolare. I cambiamenti cellulari correlati alla malattia sono controllati esclusivamente dalle proteine. Quali proteine agiscono, in quale momento e quali sono le cause sottostanti possono essere decifrati e determinati solo nel complesso contesto di un campione corporeo, a partire dal proteoma (l'insieme delle proteine).
Per la prima volta, solo l'analisi proteomica di xken® health è in grado di definire quotidianamente le malattie a livello molecolare, dove hanno origine. Questa analisi decifra l'intero decorso molecolare delle malattie negli esseri umani attraverso il proteoma e lo specifica per ogni singola patologia. Il proteoma consente di identificare l'insorgenza precoce delle malattie, così come la differenziazione tra le diverse patologie e a quali farmaci, inclusi i nutrienti, il paziente risponde. Questo rende possibile per la prima volta l'unica terapia medica attualmente disponibile su una base molecolare scientifica complessa e affidabile: il proteoma.
Nefropatia
Circa una persona su dieci soffre di malattia renale cronica (CKD), spesso inosservata, poiché la malattia non causa sintomi evidenti nelle sue fasi iniziali. Spesso viene diagnosticata troppo tardi, sulla base dei sintomi clinici, quando il danno renale è già avanzato. A quel punto, non è più possibile un trattamento efficace. La progressione del danno d'organo può essere solo rallentata, non arrestata. Se non trattata, la MRC porta a insufficienza renale e tossicità renale, e alla morte entro pochi giorni. La terapia sostitutiva renale, come la dialisi, ha conseguenze significative a lungo termine e persino un trapianto riuscito (circa il 30% dei trapianti viene rigettato) offre solo una durata di vita limitata. La malattia renale cronica è associata a un'aspettativa di vita significativamente ridotta: a seconda della gravità della malattia, può essere ridotta fino a 18 anni.
Sindrome cardiorenale: l'interazione tra cuore e reni!
La sindrome cardiorenale (CRS) si riferisce alla comparsa simultanea di disfunzione cardiaca e renale. La disfunzione di un organo porta alla compromissione dell'altro. Numerosi studi hanno dimostrato che le malattie cardiovascolari sono significativamente più comuni nei pazienti con malattia renale cronica (CKD). Allo stesso modo, molti pazienti con insufficienza cardiaca soffrono di compromissione della funzionalità renale. Entrambi gli organi sono interconnessi attraverso numerosi meccanismi, tra cui la regolazione della pressione sanguigna, l'elevato fabbisogno energetico e la vascolarizzazione. Di conseguenza, entrambi gli organi sono anche interessati da processi patologici sistemici come il danno endoteliale (danno al rivestimento interno dei vasi sanguigni), l'infiammazione o la fibrosi (eccessiva formazione di tessuto connettivo). I principali meccanismi patofisiologici della CRS includono alterazioni del metabolismo del glucosio, attivazione neuro-ormonale e stress ossidativo. Crescenti evidenze scientifiche indicano che la fibrosi svolge un ruolo cruciale nello sviluppo della malattia. In molti casi, la fibrosi si sviluppa anche prima della presentazione clinica della CRS. Nuovi biomarcatori che misurano i cambiamenti nel metabolismo del collagene nella matrice extracellulare del cuore e dei reni consentono la diagnosi precoce di processi di rimodellamento fibrotico subclinico. Ciò apre promettenti possibilità per una terapia personalizzata della sindrome cardiorenale.
La chiave per un trattamento efficace risiede in una terapia precoce e mirata, che può rallentare o addirittura prevenire la progressione della malattia. Quanto prima viene diagnosticata la malattia, tanto più efficaci saranno i cambiamenti nello stile di vita, tra cui una dieta più sana e l'esercizio fisico, con o senza farmaci. Oggi sono disponibili per i pazienti diversi farmaci in grado di rallentare la progressione della malattia renale cronica. Tuttavia, non tutti i pazienti rispondono allo stesso modo al trattamento. Finora non esisteva un metodo affidabile per prevedere quale terapia fosse più adatta a un particolare paziente.
Analisi proteomica (PA): una svolta nella diagnosi e nella terapia della malattia renale cronica e della sindrome cardiorenale, basata sullo stato attuale delle conoscenze medico-scientifiche e sulla letteratura e sugli studi pubblicati:
L'analisi del proteoma urinario offre un approccio completamente nuovo alla diagnosi precoce e al trattamento personalizzato della malattia renale cronica. Permette di:
- Rilevazione precoce della malattia renale, prima che si verifichino danni irreversibili agli organi, in modo da poter intervenire tempestivamente.
- Determinare il tipo esatto di malattia renale, senza i rischi e le limitazioni di una biopsia renale invasiva, basandosi esclusivamente sullo specifico modello del proteoma.
- Raccomandazione di una terapia personalizzata, prevedendo quale trattamento è più adatto al singolo paziente.
Benefici per i pazienti
L'applicazione dell'analisi proteomica offre numerosi vantaggi:
Aumento dell'aspettativa di vita e salvaguardia della funzionalità renale attraverso diagnosi precoce e terapia mirata.
Trattamento ottimizzato e personalizzato con la migliore terapia possibile per ogni singolo paziente.
Evitare procedure invasive come la biopsia renale mediante analisi delle urine non invasive.
a. Rilevazione precoce
Sono ora disponibili metodi diagnostici e prognostici moderni e non invasivi, che consentono diagnosi, prognosi e terapie mirate affidabili (vedi figura). Pertanto, la diagnostica molecolare dovrebbe essere presa in considerazione per i pazienti con fattori di rischio rilevanti (diabete, ipertensione, età, obesità, funzionalità renale potenzialmente compromessa, anomalie urinarie non specificate). Un metodo non invasivo per la diagnosi precoce o l'esclusione della malattia renale cronica (CKD) che è stato testato in numerosi studi è il pattern proteomico urinario CKD273, basato su un algoritmo di intelligenza artificiale che valuta 273 peptidi e proteine nelle urine [4].
b. Biopsia liquida – invece di una biopsia!
Alcune patologie rilevanti possono essere escluse o confermate in base all'anamnesi, alle procedure di imaging e alla presenza di diabete (vedere Figura 1).
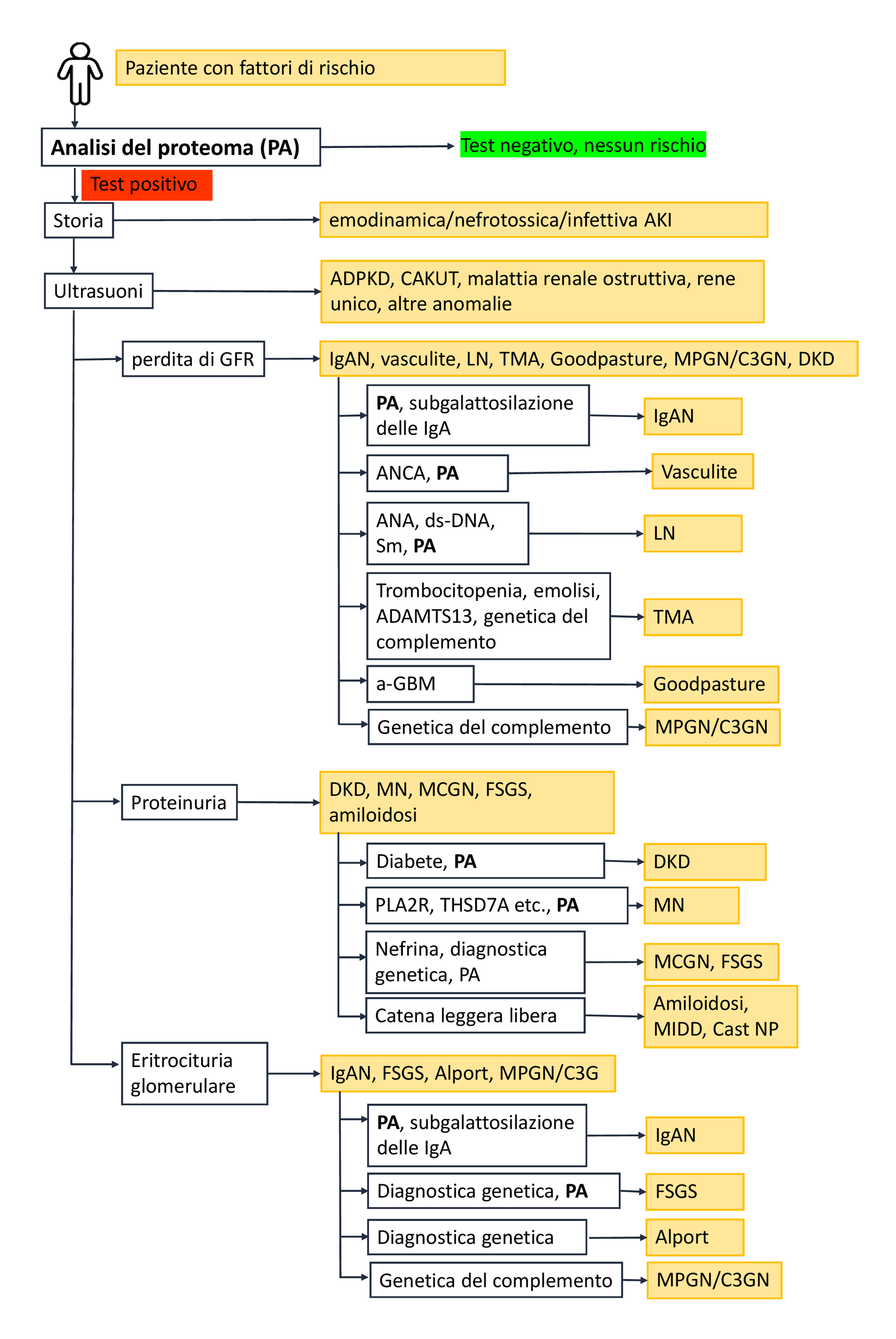
Figura 1: Albero decisionale proposto per un approccio diagnostico non invasivo basato su biomarcatori nella malattia renale cronica (CKD). Sulla base dell'attuale letteratura scientifica, i biomarcatori prognostici e predittivi disponibili a supporto della gestione della CKD sono stati combinati per fornire indicazioni per la loro applicazione. La figura mostra i biomarcatori disponibili e i loro potenziali utilizzi per specifiche patologie. Se questo albero decisionale non porta a una diagnosi definitiva, è necessario considerare ulteriori biomarcatori, in particolare nelle malattie rare, a seconda della presentazione clinica. Se non è possibile ottenere una diagnosi definitiva e raccomandazioni terapeutiche sufficientemente affidabili, l'approccio diagnostico invasivo tramite biopsia renale rimane l'ultima opzione.
Il danno renale acuto (AKI) causato da problemi circolatori può solitamente essere diagnosticato in modo affidabile sulla base dell'anamnesi del paziente. Le caratteristiche di imaging caratteristiche consentono anche la diagnosi di malattia renale policistica autosomica dominante (ADPKD), nonché di malattie renali ostruttive come le ostruzioni congenite del tratto urogenitale (CAKUT). Nelle malattie renali strutturali non causate da diabete o ipertensione, il passo diagnostico successivo è la diagnosi differenziale. A questo scopo possono essere utilizzati specifici pattern peptidici urinari [5, 6]. In caso di proteinuria glomerulare, nefrosica e non selettiva, si devono prendere in considerazione la glomerulonefrite membranoproliferativa (MPGN/C3GN), la glomerulosclerosi focale segmentale (FSGS), la malattia a lesioni minime (MCGN), la nefropatia membranosa (MN) o l'amiloidosi renale. L'amiloidosi renale può essere confermata o esclusa in base al rapporto tra catene leggere lambda e kappa. La nefropatia membranosa (MN) può essere rilevata da autoanticorpi specifici. Se non sono presenti né un profilo anomalo delle catene leggere né autoanticorpi per la MN, è probabile che si tratti di MCGN o FSGS.
Le glomerulopatie infiammatorie sono caratterizzate dall'escrezione di eritrociti nelle urine. Un'ulteriore differenziazione è possibile attraverso modelli proteomici urinari altamente specifici o analisi genomiche. La sindrome di Alport può essere diagnosticata sulla base di eritrociti dismorfici nelle urine e di mutazioni note nel gene del collagene IV. La nefropatia da IgA (IgAN), la glomerulonefrite più comune al mondo, può essere rilevata con elevata accuratezza dal modello proteomico urinario IgAN237 [7].
L'insufficienza renale acuta, associata a proteinuria ed eritrociti dismorfici nelle urine, suggerisce una malattia dell'intero compartimento glomerulare con proliferazione extracapillare. La sindrome di Goodpasture può essere diagnosticata rilevando anticorpi contro la membrana basale glomerulare. Nella vasculite autoimmune, gli anticorpi ANCA sono indicativi. La nefrite lupica può essere diagnosticata rilevando anticorpi antinucleo e anti-dsDNA.
Grazie a decenni di ricerca, è ora possibile valutare l'affidabilità diagnostica di biomarcatori, analisi genetiche e pattern proteomici utilizzando i gold standard istomorfologici esistenti. I primi passi verso una "biopsia renale liquida" non invasiva sono già stati compiuti. Questa tecnologia è già disponibile oggi e consente di evitare la biopsia renale e i rischi ad essa associati.
c. Determinazione dei farmaci
Sulla base del modello proteomico nelle urine, è possibile prevedere a quali farmaci o altri interventi terapeutici (ad esempio, cambiamenti nello stile di vita, dieta, ecc.) il paziente risponderà [8]. In questo modo, è possibile determinare la terapia ottimale e personalizzata per ciascun paziente.
L'attuale stato avanzato diagnosticabile della malattia e la terapia che solo allora inizia
Attualmente, la malattia renale cronica (CKD) viene solitamente diagnosticata solo quando è già presente un danno d'organo significativo. Ciò viene fatto misurando la velocità di filtrazione glomerulare (GFR), che indica una riduzione della funzionalità renale superiore al 50%, oppure rilevando un'aumentata escrezione di albumina nelle urine. Poiché il 50% dei pazienti con filtrazione renale compromessa e danno renale significativo non ha mostrato anomalie nell'escrezione urinaria di albumina (l'albumina è una proteina molto grande), questo parametro non è adatto per rilevare le fasi precoci della malattia. Questa è la conclusione della FDA, che, nella sua Lettera di Supporto, sostiene l'analisi proteomica [2].
Per determinare con precisione la patologia renale sottostante, spesso si esegue una biopsia renale. Questa consiste nel prelevare un campione di tessuto renale con un ago cavo, che viene poi esaminato da uno specialista (patologo). Tuttavia, questa procedura è altamente invasiva, comporta rischi significativi e non è adatta a tutti i pazienti.
Conclusione
L'analisi proteomica delle urine rappresenta un'innovazione rivoluzionaria in nefrologia. Permette di rilevare la malattia renale cronica (CKD) in fase precoce, prevenire l'insufficienza d'organo e personalizzare il trattamento per ogni singolo paziente. Ciò può non solo prevenire la necessità di dialisi o trapianto in molti casi, ma anche migliorare significativamente l'aspettativa e la qualità della vita dei pazienti.
Malattie tumorali
Il cancro può svilupparsi in vari organi del corpo e originarsi da diversi tipi di cellule. La maggior parte dei tumori ha origine sulle superfici interne ed esterne del corpo.
Cancro alla prostata
Il cancro alla prostata (PCa) è il tipo di cancro più comune negli uomini in Germania [9]. Il numero di nuovi casi di cancro alla prostata nel 2022 era di circa 74.895. Il cancro alla prostata raramente si verifica prima dei 50 anni. Negli uomini più anziani, il PCa si riscontra nella maggior parte dei pazienti, ma nella maggior parte dei casi è di bassa malignità [2].
Il test del PSA è il test più comunemente utilizzato per lo screening del cancro alla prostata. Il test del PSA misura l'antigene prostatico specifico. Non è un biomarcatore specifico per la diagnosi del cancro alla prostata. È semplicemente un indicatore di alterazioni della prostata. Queste alterazioni possono avere molte cause non correlate al cancro alla prostata (vedi Figura 2).

Figura 2: Possibili cause di un livello elevato di PSA.
Fonti di errore nella valutazione del valore del PSA [11]
- Variazioni intra-individuali: i valori del PSA possono variare del +/-15%.
- Metodo di misurazione: ci sono variazioni tra i laboratori (fino a circa il 5%).
- Manipolazione dei campioni: è fondamentale una manipolazione corretta, con periodi di stabilità specifici per i campioni centrifugati.
- Infezione del tratto urinario: le infezioni possono causare livelli di PSA molto elevati (>100 ng/ml), la cui normalizzazione può richiedere fino a un anno.
- Ritenzione urinaria acuta: questa condizione aumenta moderatamente i livelli di PSA.
- Biopsia: i test del PSA devono essere rimandati di almeno un mese dopo le biopsie.
- Ipogonadismo: la produzione di PSA dipende dai livelli di testosterone e influisce sui livelli di PSA negli uomini con bassi livelli di testosterone.
- La produzione dell'antigene prostatico specifico è androgeno-dipendente e gli inibitori della 5α-reduttasi (ad esempio finasteride, dutasteride), utilizzati nell'iperplasia prostatica benigna, abbassano il livello di PSA del 50%.
Il dilemma della diagnosi del cancro alla prostata mediante PSA: la causa di biopsie inutili e di trattamenti eccessivi!
L'unica correzione necessaria al sospetto prevalentemente falso di cancro basato su livelli elevati di PSA è attualmente la biopsia invasiva, associata a significativi effetti collaterali. Tuttavia, i risultati della biopsia prostatica spesso producono falsi positivi e falsi negativi, portando in molti casi a un sovratrattamento: il 90% di tutti i trattamenti radicali alla prostata non è necessario, con conseguenti limitazioni significative – incontinenza/impotenza – e inoltre, rischi inutili. I risultati dello studio ProtecT [12], che hanno mostrato un sovratrattamento nel 90% di tutti i trattamenti e le biopsie, hanno portato a una crisi di fiducia tra i pazienti nella medicina nel suo complesso.
La probabilità che gli aghi per biopsia non individuino il tumore è elevata. Un numero maggiore di biopsie – fino a 12 aghi possono essere inseriti nella prostata invece di 6 – e biopsie ripetute sono state concepite per compensare questo problema. Tuttavia, l'aumento del numero di biopsie e delle biopsie ripetute aumenta esponenzialmente anche il rischio di infiammazione, metastasi tumorali e, di conseguenza, di rischi per la salute nella diagnosi del cancro alla prostata.
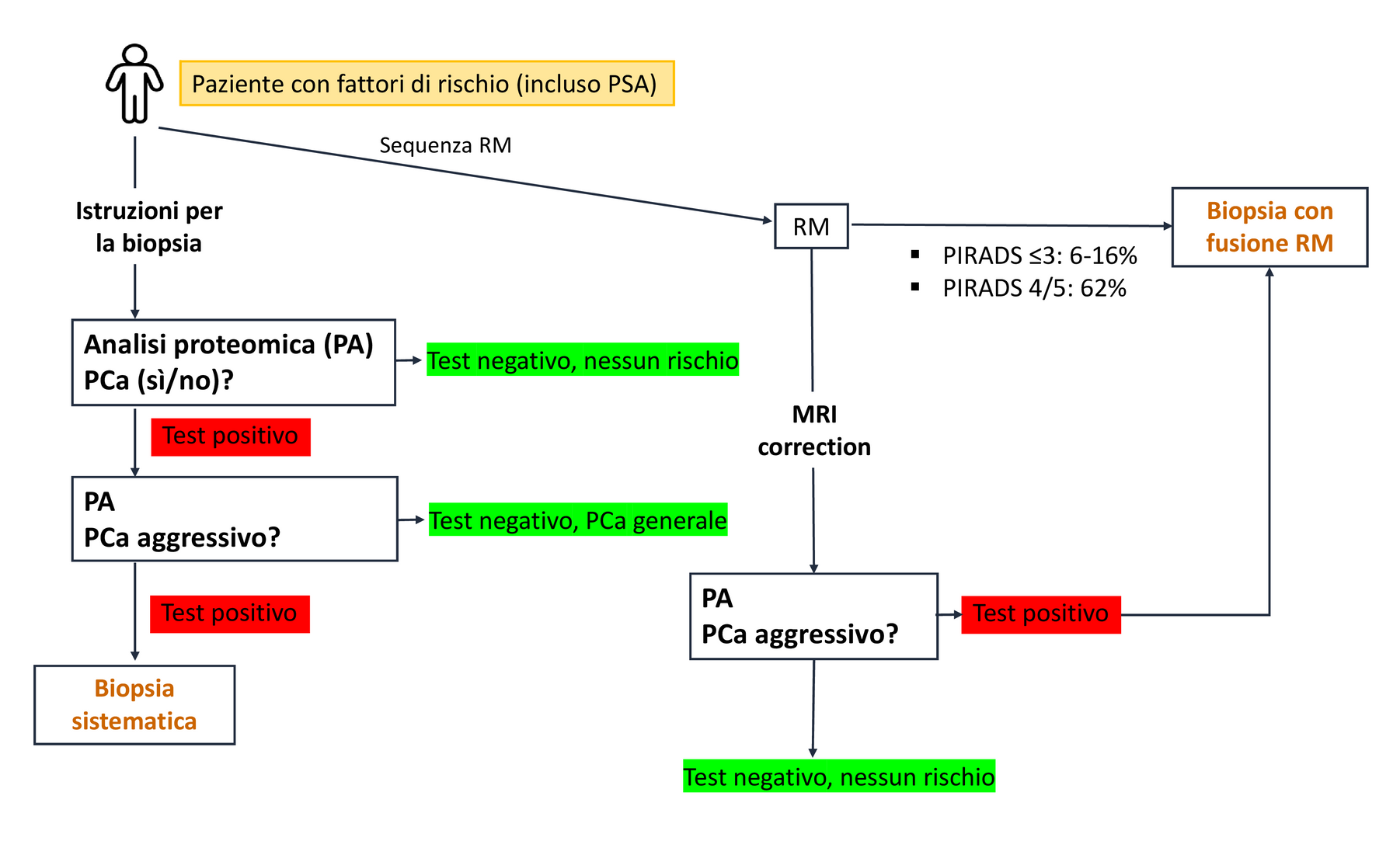
Figura 3: Albero decisionale proposto per un approccio diagnostico non invasivo basato su biomarcatori per il cancro alla prostata (PCa). La figura mostra le opzioni diagnostiche disponibili. Se non è possibile ottenere una diagnosi definitiva e una raccomandazione terapeutica sufficientemente affidabile, l'approccio diagnostico invasivo tramite biopsia prostatica rimane l'ultima opzione.
Prima di eseguire una biopsia prostatica invasiva in un paziente con un livello di PSA elevato, è necessario prendere in considerazione altre opzioni non invasive (vedere Figura 3). Questo obiettivo dovrebbe essere raggiunto sempre più utilizzando la mpMRI e la biopsia a fusione. La RM ha una sensibilità complessiva del 91% e una specificità complessiva del 37% per il cancro clinicamente significativo (ISUP ≥GG2) [11]. Ciò significa che il 63% dei pazienti sottoposti a biopsia non presenterebbe un cancro clinicamente significativo.
Un altro limite della risonanza magnetica è che il 40-50% degli uomini sottoposti a risonanza magnetica non riceve una chiara indicazione della presenza di un tumore significativo (PIRADS ≤3). Poiché il risultato è ambiguo e il rischio di cancro alla prostata significativo è solo del 6-16%, questi pazienti vengono solitamente sottoposti a una biopsia invasiva [11]. Le compagnie di assicurazione sanitaria generalmente non coprono i costi della risonanza magnetica precedente, che ammontano a circa 1.000 € (fino a 2.000 €), ma solo la biopsia invasiva.
Per correggere i risultati del PSA e della risonanza magnetica, le linee guida EAU raccomandano la stratificazione del rischio utilizzando metodi alternativi o biomarcatori per evitare scansioni di risonanza magnetica e procedure di biopsia.
L'analisi proteomica, con la sua definizione e identificazione scientifica, rappresenta lo stato attuale delle conoscenze mediche.
Perché questo approccio metodologico è così preciso? Le cellule hanno bisogno di rinnovarsi costantemente. Alcune lo fanno rapidamente, altre impiegano settimane. Se i segnali di rigenerazione sono difettosi, possono formarsi cellule superflue. Se questo non viene compensato dai meccanismi complessi dell'organismo, si formano le cosiddette cellule maligne. Questa è la base dello sviluppo del cancro, la cui crescita è favorita dai processi infiammatori nell'organismo, che possono anche essere causati dall'ambiente e da una catena alimentare contaminata. Poiché questi cambiamenti cellulari nell'organismo sono controllati esclusivamente dalle proteine, l'analisi proteomica è il primo metodo in grado di mappare queste alterazioni. La conferma negli studi si basa sui limiti di approcci metodologici come il PSA e la biopsia. Si può presumere che l'accuratezza dell'analisi proteomica sia addirittura qualitativamente migliore di quanto attualmente riportato. Secondo gli studi disponibili, l'analisi proteomica è estremamente utile sia nella sua rilevazione con un valore predittivo negativo del 93-94% [13, 14, 15] sia nel determinare se è presente un cancro alla prostata pericoloso e dovrebbe essere eseguita dopo un riscontro anomalo di PSA prima di diagnosi o terapie invasive.
Conclusione
L'analisi proteomica non solo corregge il test del PSA nei suoi risultati prevalentemente falsi positivi, ma grazie al suo approccio metodologico scientifico è anche in grado di rilevare risultati di tumori gravi precedentemente non rilevati.
Riferimenti
- https://innovation-radar.ec.europa.eu/innovation/58774
- https://www.fda.gov/media/99837/download
- Risoluzione ONU A/RES/66/2 (2011)
- Good et al., Proteomica molecolare e cellulare 2010, 9(11):2424-37.
- Siwy et al.,Nephrol Dial Transplant2017, 32(12):2079-2089.
- Mavrogeorgis et al.,Nephrol Dial Transplant28 febbraio 2024;39(3):453-462.
- Rudnicki et al.,Nephrol Dial Transplant2021, 37(1):42-52.
- Jaimes Campos et al., Pharmaceuticals (Basilea) 2023, 16(9):1298.
- Robert Koch Institute, Center for Cancer Registry Data, query al database con dati fino al 2022.
- Haas e altri, Can J Urol. 2008, 15(1):3866-71.
- Cornford e altri, Eur Urol. 2024, 86(2):148-163.
- Hamdy et al., N Engl J Med. 2023, 388(17):1547-1558.
- Frantzi et al., Br J Cancer. 2019, 120(12):1120-1128.
- Frantzi et al., Mondo J Urol. 2022, 40(9):2195-2203.
- Frantzi et al., Pathobiology 2024, 11:1-10.





