xken health
Dépistage précoce et thérapie personnalisée des maladies chroniques, y compris les maladies tumorales, grâce à l'analyse protéomique du filtrat sanguin et de l'urine.
- sans risque - indolore - fiable -

Maladies chroniques
Le changement de paradigme disruptif consistant à enfin définir les maladies chroniques au niveau moléculaire, permettant ainsi une détection précoce et l'attribution de médicaments individuellement efficaces aux patients, a incité la Commission européenne à identifier la protéomique comme la technologie clé ayant la plus grande pertinence commerciale parmi 13 000 innovations financées [1].
Depuis 2002, plus de 100 essais cliniques ont été menés, impliquant 1 200 médecins et scientifiques de renom issus de plus de 95 centres hospitaliers universitaires à travers le monde. Leurs résultats ont été publiés dans plus de 450 articles de revues scientifiques prestigieuses et reflètent l’état actuel des connaissances médicales.
L'ONU considère les maladies chroniques comme un fléau de la civilisation occidentale et les place au même niveau de menace qu'Ebola [3]. Leur détection, souvent trop tardive, en est la cause. Actuellement, ces maladies ne sont pas diagnostiquées au niveau moléculaire, là où elles prennent naissance, mais uniquement en raison d'une altération fonctionnelle massive de l'organe touché. Or, les maladies n'apparaissent qu'au niveau moléculaire. Les modifications cellulaires liées à la maladie sont exclusivement contrôlées par les protéines. Seule l'analyse du protéome (l'ensemble des protéines) d'un échantillon biologique, dans le contexte complexe de ce dernier, permet de décrypter et de déterminer quelles protéines interviennent, à quel moment, et quelles sont les causes sous-jacentes.
Pour la première fois, seule l'analyse protéomique de xken® health permet de définir les maladies au quotidien, au niveau moléculaire précis de leur origine. Elle décrypte l'évolution moléculaire complète de la maladie chez l'humain grâce au protéome et la spécifie pour chaque pathologie. Le protéome permet d'identifier les premiers signes de la maladie, de différencier les pathologies et de déterminer les médicaments – y compris les nutriments – auxquels le patient répond. Ainsi, le seul traitement médical actuellement disponible repose pour la première fois sur une base moléculaire scientifique complexe et fiable : le protéome.
Maladie du rein
Environ une personne sur dix souffre d'insuffisance rénale chronique (IRC), souvent asymptomatique à ses débuts. Le diagnostic est souvent posé trop tard, sur la base des symptômes cliniques, lorsque les lésions rénales sont déjà avancées. À ce stade, aucun traitement efficace n'est plus possible. La progression des lésions ne peut être que ralentie, et non stoppée. Sans traitement, l'IRC conduit à une insuffisance rénale terminale et à une néphrotoxicité, et au décès en quelques jours. Les traitements de suppléance rénale, comme la dialyse, ont des conséquences importantes à long terme, et même une transplantation réussie (environ 30 % des greffes sont rejetées) n'offre qu'une espérance de vie limitée. L'insuffisance rénale chronique est associée à une réduction significative de l'espérance de vie : selon la gravité de la maladie, celle-ci peut être réduite jusqu'à 18 ans.
Syndrome cardiorénal - l'interaction entre le cœur et les reins !
Le syndrome cardiorénal (SCR) désigne la survenue simultanée d'un dysfonctionnement cardiaque et rénal. Le dysfonctionnement d'un organe entraîne une atteinte de l'autre. De nombreuses études ont montré que les maladies cardiovasculaires sont significativement plus fréquentes chez les patients atteints d'insuffisance rénale chronique (IRC). De même, de nombreux patients souffrant d'insuffisance cardiaque présentent une altération de la fonction rénale. Ces deux organes sont interconnectés par de nombreux mécanismes, notamment la régulation de la pression artérielle, les besoins énergétiques élevés et la vascularisation. Par conséquent, ils sont également affectés par des processus pathologiques systémiques tels que les lésions endothéliales (atteinte de la paroi interne des vaisseaux sanguins), l'inflammation ou la fibrose (formation excessive de tissu conjonctif). Les principaux mécanismes physiopathologiques du SCR comprennent une altération du métabolisme du glucose, l'activation neurohormonale et le stress oxydatif. De plus en plus de données scientifiques indiquent que la fibrose joue un rôle crucial dans le développement de la maladie. Dans de nombreux cas, la fibrose se développe avant même l'apparition des symptômes cliniques du SCR. De nouveaux biomarqueurs mesurant les modifications du métabolisme du collagène dans la matrice extracellulaire du cœur et des reins permettent la détection précoce des processus de remodelage fibrotique infracliniques. Cela ouvre des perspectives prometteuses pour une thérapie personnalisée du syndrome cardiorénal.
La clé d'un traitement réussi réside dans une prise en charge précoce et ciblée, capable de ralentir, voire de stopper, la progression de la maladie. Plus le diagnostic est précoce, plus les changements de mode de vie – notamment une alimentation plus saine et une activité physique régulière – seront efficaces, avec ou sans médicaments. De nombreux médicaments sont désormais disponibles pour ralentir la progression de l'insuffisance rénale chronique. Cependant, tous les patients ne répondent pas de la même manière au traitement. Jusqu'à présent, il n'existait aucune méthode fiable pour prédire quel traitement serait le plus adapté à chaque patient.
L’analyse protéomique (AP) – une avancée majeure dans le diagnostic et le traitement des maladies rénales chroniques et du syndrome cardiorénal – basée sur l’état actuel des connaissances médicales et scientifiques et sur la littérature et les études publiées :
L'analyse du protéome urinaire offre une approche totalement inédite pour le dépistage précoce et le traitement personnalisé de l'insuffisance rénale chronique. Elle permet :
- Dépistage précoce des maladies rénales – avant que des lésions irréversibles de l’organe ne surviennent, afin qu’une intervention précoce soit possible.
- Déterminer le type exact de maladie rénale – sans les risques et les limites d'une biopsie rénale invasive, uniquement sur la base du profil protéomique spécifique.
- Recommandation thérapeutique personnalisée – en prédisant quel traitement est le mieux adapté à chaque patient.
Avantages pour les patients
L'application de l'analyse protéomique offre de nombreux avantages :
Augmentation de l'espérance de vie et préservation de la fonction rénale grâce à un diagnostic précoce et à une thérapie ciblée.
Un traitement optimisé et personnalisé, offrant la meilleure thérapie possible pour chaque patient.
Éviter les procédures invasives telles que la biopsie rénale grâce à une analyse d'urine non invasive.
a. Détection précoce
Des méthodes modernes de diagnostic et de pronostic non invasives sont désormais disponibles, permettant un diagnostic fiable, un pronostic précis et des thérapies ciblées (voir figure). Par conséquent, le diagnostic moléculaire doit être envisagé chez les patients présentant des facteurs de risque pertinents (diabète, hypertension, âge avancé, obésité, insuffisance rénale potentielle, anomalies urinaires non spécifiées). Parmi les méthodes non invasives de dépistage précoce ou d'exclusion de la maladie rénale chronique (MRC) ayant fait l'objet de nombreuses études, on trouve le profil protéomique urinaire CKD273, basé sur un algorithme d'intelligence artificielle qui analyse 273 peptides et protéines urinaires [4].
b. Biopsie liquide – au lieu d’une biopsie !
Certaines maladies pertinentes peuvent être exclues ou confirmées en fonction des antécédents médicaux, des procédures d'imagerie et de la présence de diabète (voir figure 1).
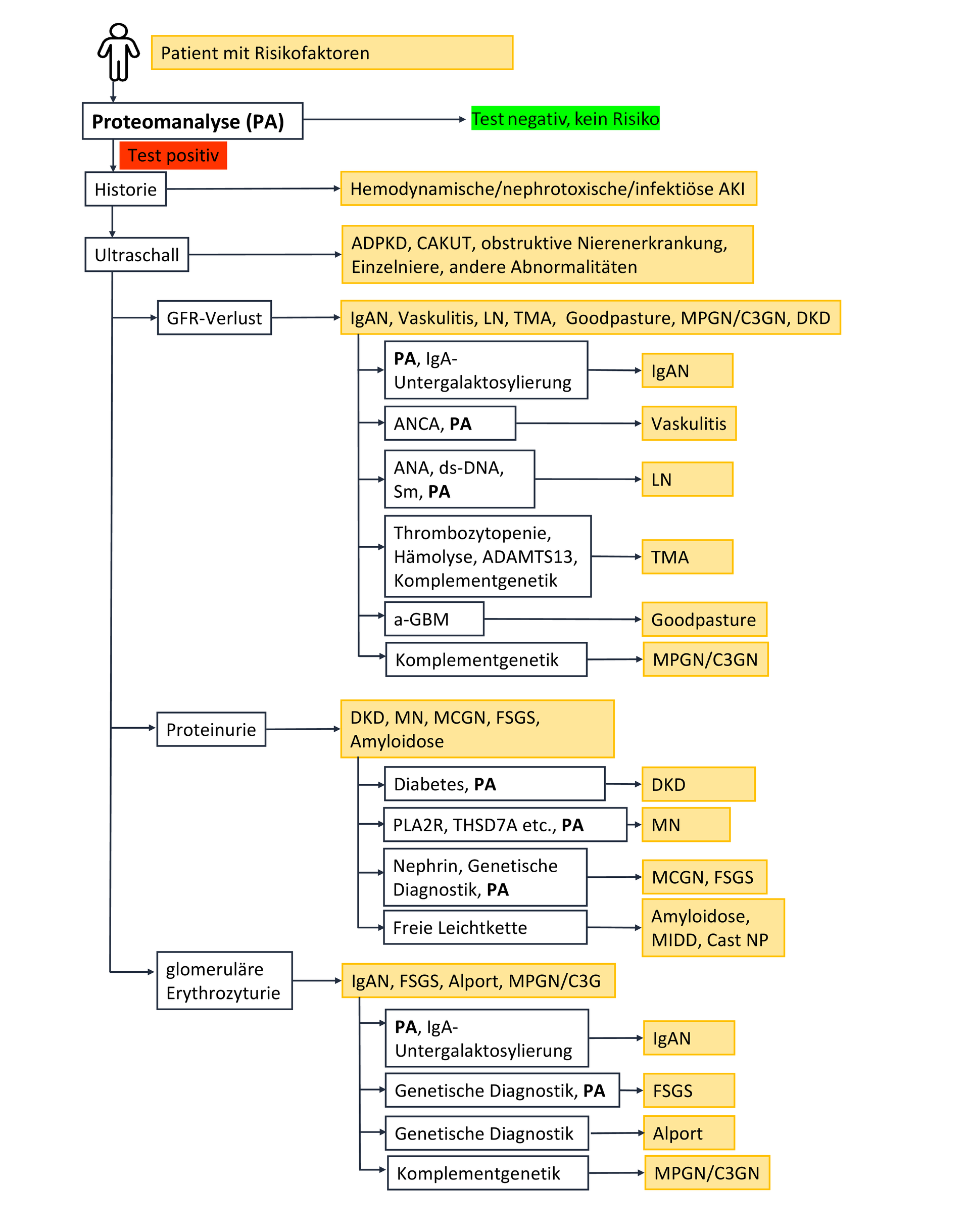
Figure 1 : Arbre décisionnel proposé pour une approche diagnostique non invasive basée sur les biomarqueurs dans la maladie rénale chronique (MRC). D’après la littérature scientifique actuelle, les biomarqueurs pronostiques et prédictifs disponibles pour la prise en charge de la MRC ont été combinés afin de guider leur application. La figure présente les biomarqueurs disponibles et leurs utilisations potentielles pour des maladies spécifiques. Si cet arbre décisionnel ne permet pas d’établir un diagnostic définitif, des biomarqueurs supplémentaires, notamment dans les maladies rares, doivent être envisagés en fonction du tableau clinique. Si un diagnostic définitif et des recommandations thérapeutiques suffisamment fiables ne peuvent être établis, la biopsie rénale reste l’approche diagnostique invasive de dernier recours.
L'insuffisance rénale aiguë (IRA) d'origine circulatoire peut généralement être diagnostiquée avec fiabilité grâce aux antécédents médicaux du patient. Les caractéristiques d'imagerie permettent également de diagnostiquer la polykystose rénale autosomique dominante (PKRAD), ainsi que les néphropathies obstructives telles que les anomalies congénitales des voies urinaires et génitales (ACVUG). Dans les néphropathies structurelles non liées au diabète ou à l'hypertension, l'étape diagnostique suivante est le diagnostic différentiel. Des profils peptidiques urinaires spécifiques [5, 6] peuvent être utilisés à cette fin. En cas de protéinurie glomérulaire, néphrotique ou non sélective, il convient d'envisager une glomérulonéphrite membranoproliférative (GNMP/C3GP), une hyalinose segmentaire et focale (HSF), une glomérulonéphrite à lésions glomérulaires minimes (GLGM), une néphropathie membraneuse (NM) ou une amylose rénale. Le diagnostic d'amylose rénale peut être confirmé ou infirmé par le rapport des chaînes légères lambda/kappa. La néphropathie membraneuse (NM) peut être détectée par des auto-anticorps spécifiques. En l'absence d'un profil de chaînes légères anormal et d'auto-anticorps anti-NM, une glomérulonéphrite à lésions glomérulaires minimes (GNLM) ou une hyalinose segmentaire et focale (HSF) sont probables.
Les glomérulopathies inflammatoires sont caractérisées par l'excrétion d'érythrocytes dans les urines. Un diagnostic plus précis est possible grâce à des profils protéomiques urinaires très spécifiques ou à des analyses génomiques. Le syndrome d'Alport peut être diagnostiqué sur la base de la présence d'érythrocytes dysmorphiques dans les urines, ainsi que par des mutations connues du gène du collagène IV. La néphropathie à IgA (IgAN), la glomérulonéphrite la plus fréquente au monde, peut être détectée avec une grande précision grâce au profil protéomique urinaire IgAN237 [7].
L'insuffisance rénale aiguë, associée à une protéinurie et à la présence d'érythrocytes dysmorphiques dans les urines, évoque une atteinte glomérulaire complète avec prolifération extracapillaire. Le syndrome de Goodpasture peut être diagnostiqué par la recherche d'anticorps dirigés contre la membrane basale glomérulaire. Dans les vascularites auto-immunes, la présence d'anticorps ANCA est caractéristique. La néphrite lupique peut être diagnostiquée par la recherche d'anticorps antinucléaires et d'anticorps anti-ADN double brin.
Grâce à des décennies de recherche, il est désormais possible d'évaluer la fiabilité diagnostique des biomarqueurs, des analyses génétiques et des profils protéomiques à l'aide des méthodes histomorphologiques de référence. Les premiers pas vers une « biopsie rénale liquide » non invasive ont déjà été franchis. Cette technologie est d'ores et déjà utilisable et permet d'éviter la biopsie rénale et ses risques associés.
c. Détermination des médicaments
L’analyse du profil protéomique urinaire permet de prédire la réponse du patient aux médicaments ou autres interventions thérapeutiques (modifications du mode de vie, régime alimentaire, etc.) [8]. Ainsi, un traitement optimal et personnalisé peut être mis en place pour chaque patient.
Le stade avancé de la maladie, diagnostiquable à ce stade, et le traitement qui ne commence qu'à ce moment-là, débutent.
Actuellement, l'insuffisance rénale chronique (IRC) n'est généralement diagnostiquée qu'en présence de lésions organiques importantes. Ce diagnostic repose soit sur la mesure du débit de filtration glomérulaire (DFG), qui indique une réduction de la fonction rénale supérieure à 50 %, soit sur la détection d'une augmentation de l'excrétion d'albumine dans les urines. Or, comme 50 % des patients présentant une insuffisance rénale et des lésions rénales importantes ne présentent aucune anomalie de l'excrétion urinaire d'albumine (l'albumine étant une protéine de grande taille), ce paramètre est inadapté au dépistage précoce de la maladie. C'est la conclusion de la FDA qui, dans sa lettre de soutien, préconise le recours à l'analyse protéomique [2].
Pour déterminer avec précision la cause de la maladie rénale sous-jacente, une biopsie rénale est souvent pratiquée. Elle consiste à prélever un échantillon de tissu rénal à l'aide d'une aiguille creuse, qui est ensuite examiné par un spécialiste (pathologiste). Cependant, cette procédure est très invasive, comporte des risques importants et ne convient pas à tous les patients.
Conclusion
L'analyse protéomique de l'urine représente une avancée majeure en néphrologie. Elle permet de détecter l'insuffisance rénale chronique à un stade précoce, de prévenir les défaillances d'organes et d'adapter le traitement à chaque patient. Ceci peut non seulement éviter le recours à la dialyse ou à la transplantation dans de nombreux cas, mais aussi améliorer significativement l'espérance et la qualité de vie des personnes atteintes.
Maladies tumorales
Le cancer peut se développer dans différents organes du corps et provient de divers types de cellules. La plupart des cancers débutent sur les surfaces internes et externes du corps.
Cancer de la prostate
Le cancer de la prostate est le cancer le plus fréquent chez l'homme en Allemagne [9]. En 2022, on a dénombré environ 74 895 nouveaux cas. Ce cancer est rare avant 50 ans. Chez les hommes plus âgés, il est présent chez la majorité d'entre eux, mais il s'agit le plus souvent d'une tumeur peu agressive [2].
Le test PSA est le test le plus couramment utilisé pour le dépistage du cancer de la prostate. Il mesure l'antigène prostatique spécifique (PSA). Ce n'est pas un biomarqueur spécifique du cancer de la prostate ; il indique simplement des modifications au niveau de la prostate. Ces modifications peuvent avoir de nombreuses causes sans lien avec le cancer de la prostate (voir figure 2).

Figure 2 : Causes possibles d'un taux de PSA élevé.
Sources d’erreur dans l’évaluation de la valeur du PSA [11]
- Variations intra-individuelles : les valeurs du PSA peuvent fluctuer de +/-15 %.
- Méthode de mesure : Il existe des variations entre les laboratoires (jusqu'à environ 5 %).
- Manipulation des échantillons : Une manipulation correcte est essentielle, avec des périodes de stabilité spécifiques pour les échantillons centrifugés.
- Infection des voies urinaires : Les infections peuvent provoquer des taux de PSA très élevés (>100 ng/ml), qui peuvent mettre jusqu'à un an à se normaliser.
- Rétention urinaire aiguë : cette affection augmente modérément les taux de PSA.
- Biopsie : Les tests PSA doivent être reportés d'au moins un mois après les biopsies.
- Hypogonadisme : la production de PSA dépend des taux de testostérone et influence ces taux chez les hommes présentant un faible taux de testostérone.
- La production d'antigène prostatique spécifique est androgéno-dépendante, et les inhibiteurs de la 5α-réductase (par exemple, le finastéride, le dutastéride), utilisés dans l'hyperplasie bénigne de la prostate, diminuent le taux de PSA de 50 %.
Le dilemme du diagnostic du cancer de la prostate par le PSA : la cause de biopsies inutiles et de surtraitements !
Actuellement, la seule correction nécessaire à la suspicion, majoritairement erronée, de cancer fondée sur un taux élevé de PSA est la biopsie invasive, associée à des effets secondaires importants. Or, les résultats des biopsies de la prostate donnent souvent des faux positifs et des faux négatifs, conduisant à un surtraitement dans de nombreux cas : 90 % des traitements radicaux de la prostate sont inutiles, entraînant des limitations importantes – incontinence/impuissance – et, de surcroît, des risques superflus. Les résultats de l’étude ProtecT [12], qui ont mis en évidence un surtraitement dans 90 % des traitements et des biopsies, ont engendré une crise de confiance des patients envers le système médical dans son ensemble.
La probabilité que les aiguilles de biopsie ne ciblent pas la tumeur est élevée. Un plus grand nombre de biopsies – jusqu'à 12 aiguilles peuvent être insérées dans la prostate au lieu de 6 – et des biopsies répétées ont été envisagées pour compenser ce risque. Cependant, l'augmentation du nombre de biopsies et de biopsies répétées accroît également de façon exponentielle les risques d'inflammation, de métastases tumorales et, par conséquent, les risques pour la santé liés au diagnostic du cancer de la prostate.
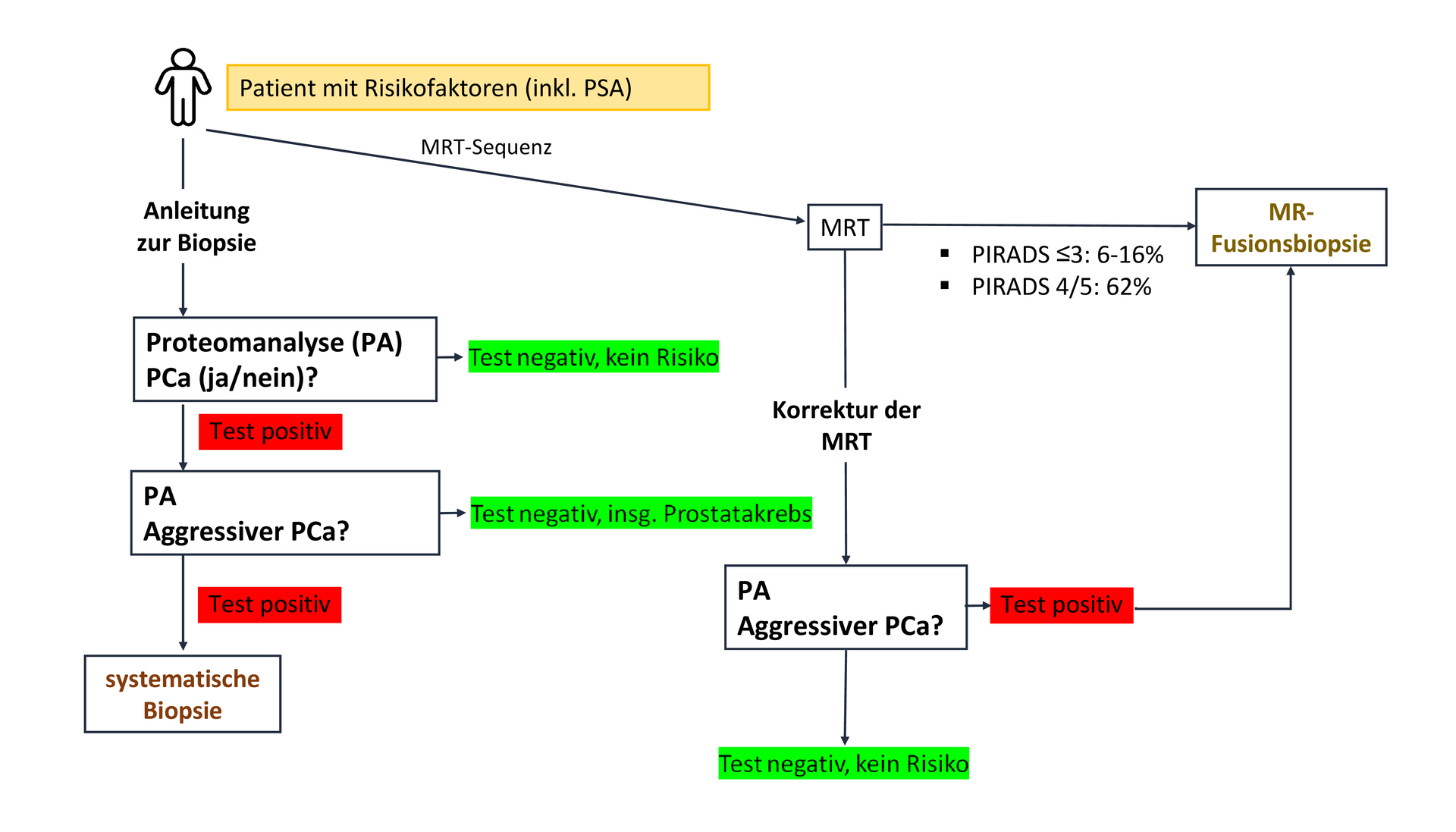
Figure 3 : Arbre décisionnel proposé pour une approche diagnostique non invasive du cancer de la prostate (CaP) basée sur des biomarqueurs. Cette figure présente les options diagnostiques disponibles. Si un diagnostic définitif et une recommandation de traitement suffisamment fiable ne peuvent être établis, la biopsie de la prostate, approche diagnostique invasive, demeure la dernière option.
Avant de réaliser une biopsie prostatique invasive chez un patient présentant un taux de PSA élevé, d'autres options non invasives doivent être envisagées (voir figure 3). Le recours à l'IRM multiparamétrique et à la biopsie par fusion d'images est de plus en plus recommandé. L'IRM présente une sensibilité globale de 91 % et une spécificité globale de 37 % pour la détection d'un cancer cliniquement significatif (ISUP ≥ GG2) [11]. Cela signifie que 63 % des patients devant subir une biopsie ne présenteraient pas de cancer cliniquement significatif.
Une autre limite de l'IRM est que 40 à 50 % des hommes qui y ont recours ne reçoivent pas d'indication claire quant à la présence d'une tumeur significative (PIRADS ≤ 3). Le résultat étant ambigu et le risque de cancer de la prostate significatif n'étant que de 6 à 16 %, ces patients sont généralement soumis à une biopsie invasive [11]. Les assurances maladie ne prennent généralement pas en charge le coût de l'IRM initiale, qui s'élève à environ 1 000 € (jusqu'à 2 000 €), mais uniquement celui de la biopsie invasive.
Pour corriger les résultats du PSA et de l'IRM, les recommandations de l'EAU préconisent une stratification des risques à l'aide de méthodes alternatives ou de biomarqueurs afin d'éviter les examens d'imagerie par résonance magnétique et les procédures de biopsie.
L'analyse protéomique, avec sa définition et son identification scientifiques, représente l'état actuel des connaissances médicales.
Pourquoi cette approche méthodologique est-elle si précise ? Les cellules ont constamment besoin de se renouveler. Certaines le font rapidement, d’autres en plusieurs semaines. Si les signaux de régénération sont défaillants, des cellules inutiles peuvent se former. Si ce phénomène n’est pas compensé par les mécanismes de l’organisme, des cellules dites malignes se développent. C’est le point de départ du cancer, dont la croissance est favorisée par des processus inflammatoires, eux-mêmes induits par l’environnement et une alimentation contaminée. Puisque ces modifications cellulaires sont exclusivement contrôlées par des protéines, l’analyse protéomique est la première méthode capable de cartographier ces altérations. La confirmation par les études repose sur les limites d’approches méthodologiques telles que le dosage du PSA et la biopsie. On peut supposer que la précision de l’analyse protéomique est qualitativement supérieure à celle actuellement rapportée. Selon les études disponibles, l'analyse protéomique est extrêmement utile à la fois pour sa détection avec une valeur prédictive négative de 93-94 % [13, 14, 15] et pour déterminer si un cancer de la prostate dangereux est présent, et devrait être effectuée après un résultat anormal de PSA avant les diagnostics ou les thérapies invasifs.
Conclusion
L'analyse protéomique corrige non seulement le test PSA et ses résultats majoritairement faux positifs, mais grâce à son approche méthodologique scientifique, elle est également capable de détecter des cancers graves passés inaperçus auparavant.
Références
- https://innovation-radar.ec.europa.eu/innovation/58774
- https://www.fda.gov/media/99837/download
- Résolution A/RES/66/2 (2011) de l'ONU
- Good et al., Molecular and Cellular Proteomics 2010, 9(11):2424-37.
- Siwy et al.,Nephrol Dial Transplant2017, 32(12):2079-2089.
- Mavrogeorgis et al.,Nephrol Dial Transplant2024 Feb 28;39(3):453-462.
- Rudnicki et al.,Nephrol Dial Transplant2021, 37(1):42-52.
- Jaimes Campos et al., Pharmaceuticals (Bâle) 2023, 16(9):1298.
- Institut Robert Koch, Centre de données du registre du cancer, requête de base de données avec des données jusqu'en 2022.
- Haas et al., Can J Urol. 2008, 15(1):3866-71.
- Cornford et al., Eur Urol. 2024, 86(2):148-163.
- Hamdy et coll., N Engl J Med. 2023, 388(17):1547-1558.
- Frantzi et al., Br J Cancer. 2019, 120(12):1120-1128.
- Frantzi et al., World J Urol. 2022, 40(9):2195-2203.
- Frantzi et al., Pathobiologie 2024, 11 : 1-10.





