xken health
Detección temprana y terapia personalizada de enfermedades crónicas, incluidas las enfermedades tumorales, mediante análisis proteómico del filtrado sanguíneo y la orina.
- sin riesgos - sin dolor - confiable -
Enfermedades crónicas
El cambio de paradigma disruptivo que supone definir finalmente las enfermedades crónicas a nivel molecular, permitiendo así la detección temprana y la asignación de medicamentos individualmente eficaces a los pacientes, ha llevado a la Comisión Europea a identificar la proteómica como la tecnología clave con la mayor relevancia de mercado entre 13.000 innovaciones financiadas [1].
Desde 2002, se han realizado más de 100 ensayos clínicos, en los que han participado 1200 médicos y científicos destacados de más de 95 hospitales universitarios de todo el mundo. Los resultados se han publicado en más de 450 artículos en revistas científicas de renombre y representan el estado actual del conocimiento médico.
La ONU identifica las enfermedades crónicas como una plaga de la civilización occidental y las sitúa en el mismo nivel de amenaza que el ébola [3]. La causa es su detección demasiado tardía. Actualmente, estas enfermedades no se reconocen a nivel molecular, donde se originan, sino únicamente por el deterioro funcional masivo del órgano afectado. Sin embargo, las enfermedades solo surgen a nivel molecular. Los cambios celulares relacionados con la enfermedad están controlados únicamente por proteínas. Qué proteínas actúan, en qué momento y cuáles son las causas subyacentes solo pueden descifrarse y determinarse dentro del complejo contexto de una muestra corporal, a partir del proteoma (la totalidad de las proteínas).
Por primera vez, solo el análisis proteómico de xken® health puede definir enfermedades a diario a nivel molecular, donde se originan. Esto descifra el curso molecular completo de la enfermedad en humanos a través del proteoma y lo especifica para cada enfermedad individual. El proteoma permite identificar la aparición temprana de enfermedades, así como la diferenciación entre enfermedades y a qué medicamentos, incluidos los nutrientes, responde el paciente. Esto hace posible, por primera vez, el único tratamiento médico disponible actualmente sobre una base científica molecular compleja y fiable: el proteoma.
Nefropatía
Aproximadamente una de cada diez personas padece enfermedad renal crónica (CKD), a menudo de forma inadvertida, ya que no causa síntomas perceptibles en sus primeras etapas. Con frecuencia, se diagnostica demasiado tarde, basándose en los síntomas clínicos, cuando el daño renal ya está avanzado. Para entonces, ya no es posible un tratamiento eficaz. La progresión del daño orgánico solo se puede ralentizar, no detener. Si no se trata, la CKD provoca insuficiencia renal, toxicidad renal y la muerte en pocos días. La terapia de reemplazo renal, como la diálisis, tiene importantes consecuencias a largo plazo, e incluso un trasplante exitoso (aproximadamente el 30 % de los trasplantes son rechazados) ofrece una esperanza de vida limitada. La enfermedad renal crónica se asocia con una esperanza de vida significativamente reducida; dependiendo de la gravedad de la enfermedad, puede acortarse hasta en 18 años.
Síndrome cardiorrenal: ¡la interacción del corazón y el riñón!
El síndrome cardiorrenal (CRS) se refiere a la aparición simultánea de disfunción cardíaca y renal. La disfunción en un órgano provoca el deterioro del otro. Numerosos estudios han demostrado que las enfermedades cardiovasculares son significativamente más frecuentes en pacientes con enfermedad renal crónica (CKD). Asimismo, muchos pacientes con insuficiencia cardíaca padecen deterioro de la función renal. Ambos órganos están interconectados a través de numerosos mecanismos, como la regulación de la presión arterial, las altas demandas energéticas y la vascularización. En consecuencia, ambos órganos también se ven afectados por procesos patológicos sistémicos como el daño endotelial (daño al revestimiento interno de los vasos sanguíneos), la inflamación o la fibrosis (formación excesiva de tejido conectivo). Los mecanismos fisiopatológicos clave del CRS incluyen el deterioro del metabolismo de la glucosa, la activación neurohormonal y el estrés oxidativo. Cada vez hay más evidencia científica que indica que la fibrosis desempeña un papel crucial en el desarrollo de la enfermedad. En muchos casos, la fibrosis se desarrolla incluso antes de la presentación clínica del CRS. Nuevos biomarcadores que miden los cambios en el metabolismo del colágeno en la matriz extracelular del corazón y los riñones permiten la detección temprana de procesos de remodelación fibrótica subclínica. Esto abre posibilidades prometedoras para la terapia personalizada del síndrome cardiorrenal.
La clave para un tratamiento exitoso reside en una terapia temprana y dirigida, que puede ralentizar o incluso prevenir la progresión de la enfermedad. Cuanto antes se diagnostique la enfermedad, más efectivos serán los cambios en el estilo de vida, incluyendo una mejor alimentación y ejercicio, con o sin medicación. Actualmente, existe una variedad de medicamentos disponibles para los pacientes que pueden ralentizar la progresión de la CKD. Sin embargo, no todos los pacientes responden por igual al tratamiento. Hasta ahora, no existía un método fiable para predecir qué terapia será la más adecuada para cada paciente.
Análisis proteómico (PA): un gran avance en el diagnóstico y el tratamiento de la enfermedad renal crónica y el síndrome cardiorrenal, basado en el estado actual del conocimiento médico/científico y la literatura y estudios publicados:
El análisis del proteoma de la orina ofrece un enfoque completamente nuevo para la detección temprana y el tratamiento personalizado de la CKD. Permite:
- Detección temprana de enfermedades renales: antes de que se produzcan daños irreversibles en los órganos, para que sea posible una intervención temprana.
- Determinar el tipo exacto de enfermedad renal, sin los riesgos y limitaciones de una biopsia renal invasiva, basándose únicamente en el patrón de proteoma específico.
- Recomendación de terapia personalizada: mediante la predicción de qué tratamiento es el más adecuado para cada paciente.
Beneficios para los pacientes
La aplicación del análisis proteómico ofrece numerosas ventajas:
Aumento de la esperanza de vida y preservación de la función renal mediante un diagnóstico precoz y una terapia dirigida.
Tratamiento optimizado y personalizado con la mejor terapia posible para cada paciente.
Evitar procedimientos invasivos como la biopsia renal mediante análisis de orina no invasivo.
a. Detección temprana
Actualmente se dispone de métodos modernos de diagnóstico y pronóstico no invasivos que permiten un diagnóstico, pronóstico y terapias dirigidas fiables (véase la figura). Por lo tanto, se debe considerar el diagnóstico molecular en pacientes con factores de riesgo relevantes (diabetes, hipertensión, edad, obesidad, posible deterioro de la función renal, anomalías urinarias no especificadas). Un método no invasivo para la detección temprana o la exclusión de la enfermedad renal crónica (CKD) que se ha probado en numerosos estudios es el patrón del proteoma urinario CKD273, basado en un algoritmo de IA que evalúa 273 péptidos y proteínas en la orina [4].
b. Biopsia líquida – ¡en lugar de una biopsia!
Ciertas enfermedades relevantes pueden descartarse o confirmarse basándose en la historia clínica, los procedimientos de imagen y la presencia de diabetes (ver Figura 1).

Figura 1: Árbol de decisión propuesto para un enfoque diagnóstico no invasivo basado en biomarcadores en la enfermedad renal crónica (CKD). Con base en la literatura científica actual, se han combinado los biomarcadores pronósticos y predictivos disponibles para apoyar el manejo de la CKD con el fin de orientar su aplicación. La figura muestra los biomarcadores disponibles y sus posibles usos para enfermedades específicas. Si este árbol de decisión no permite un diagnóstico definitivo, se deben considerar biomarcadores adicionales, especialmente en enfermedades raras, según la presentación clínica. Si no se puede obtener un diagnóstico definitivo ni recomendaciones terapéuticas suficientemente fiables, el enfoque diagnóstico invasivo mediante biopsia renal sigue siendo la última opción.
La lesión renal aguda (AKI) causada por problemas circulatorios generalmente se puede diagnosticar de manera confiable basándose en la historia clínica del paciente. Las características de imagen también permiten el diagnóstico de la enfermedad renal poliquística autosómica dominante (ADPKD), así como enfermedades renales obstructivas como las obstrucciones congénitas del tracto urogenital (CAKUT). En las enfermedades renales estructurales no causadas por diabetes o hipertensión, el siguiente paso diagnóstico es el diagnóstico diferencial. Los patrones específicos de péptidos en orina [5, 6] se pueden utilizar para este propósito. En casos de proteinuria glomerular, nefrótica y no selectiva, se debe considerar la glomerulonefritis membranoproliferativa (MPGN/C3GN), la glomeruloesclerosis focal y segmentaria (FSGS), la enfermedad de cambios mínimos (MCGN), la nefropatía membranosa (MN) o la amiloidosis renal. La amiloidosis renal se puede confirmar o descartar por la proporción de cadenas ligeras lambda a kappa. La nefropatía membranosa (MN) puede detectarse mediante autoanticuerpos específicos. Si no se presentan un perfil anormal de cadenas ligeras ni autoanticuerpos para la MN, es probable que se trate de MCGN o FSGS.
Las glomerulopatías inflamatorias se caracterizan por la excreción de eritrocitos en la orina. Es posible una mayor diferenciación mediante patrones proteómicos urinarios altamente específicos o análisis genómicos. El síndrome de Alport puede diagnosticarse basándose en eritrocitos dismórficos en la orina, así como en mutaciones conocidas en el gen del colágeno IV. La nefropatía por IgA (IgAN), la glomerulonefritis más común a nivel mundial, puede detectarse con gran precisión mediante el patrón proteómico urinario IgAN237 [7].
La insuficiencia renal rápida, combinada con proteinuria y eritrocitos dismórficos en la orina, sugiere una enfermedad de todo el compartimento glomerular con proliferación extracapilar. El síndrome de Goodpasture se puede diagnosticar mediante la detección de anticuerpos contra la membrana basal glomerular. En la vasculitis autoinmune, los anticuerpos ANCA son indicativos. La nefritis lúpica se puede diagnosticar mediante la detección de anticuerpos antinucleares y ds-DNA.
Gracias a décadas de investigación, ahora es posible evaluar la fiabilidad diagnóstica de biomarcadores, análisis genéticos y patrones proteómicos utilizando los estándares histomorfológicos de referencia existentes. Ya se han dado los primeros pasos hacia una "biopsia renal líquida" no invasiva. Esta tecnología ya se puede utilizar hoy en día y permite evitar la biopsia renal y sus riesgos asociados.
c. Determinación de medicamentos
Con base en el patrón proteómico en la orina, es posible predecir a qué medicamentos u otras intervenciones terapéuticas (p. ej., cambios en el estilo de vida, dieta, etc.) responderá el paciente [8]. De esta manera, se puede determinar la terapia óptima y personalizada para cada paciente.
El estado avanzado diagnosticable actual de la enfermedad y la terapia que recién entonces comienza
Actualmente, la enfermedad renal crónica (CKD) suele diagnosticarse solo cuando ya existe daño orgánico significativo. Esto se realiza midiendo la tasa de filtración glomerular (GFR), que indica una reducción de la función renal superior al 50%, o detectando un aumento en la excreción urinaria de albúmina. Dado que el 50% de los pacientes con alteración de la filtración renal y daño renal significativo no presentaron anomalías en la excreción urinaria de albúmina (la albúmina es una proteína muy grande), este parámetro no es adecuado para detectar las etapas iniciales de la enfermedad. Esta es la conclusión de la FDA, que, en su Carta de Apoyo, aboga por el análisis proteómico [2].
Para determinar con precisión la enfermedad renal subyacente, a menudo se realiza una biopsia renal. Esta consiste en tomar una muestra de tejido del riñón con una aguja hueca, que posteriormente es examinada por un especialista (patólogo). Sin embargo, este procedimiento es altamente invasivo, conlleva riesgos significativos y no es adecuado para todos los pacientes.
Conclusión
El análisis proteómico de orina representa un avance revolucionario en nefrología. Permite detectar la CKD en una etapa temprana, prevenir la insuficiencia orgánica y personalizar el tratamiento para cada paciente. Esto no solo puede evitar la necesidad de diálisis o trasplante en muchos casos, sino que también mejora significativamente la esperanza y la calidad de vida de los afectados.
Enfermedades tumorales
El cáncer puede presentarse en diversos órganos del cuerpo y se origina en diferentes tipos de células. La mayoría de los cánceres comienzan en las superficies internas y externas del cuerpo.
Cáncer de próstata
El cáncer de próstata (PCa) es el tipo de cáncer más común en hombres en Alemania [9]. El número de casos nuevos de cáncer de próstata en 2022 fue de aproximadamente 74.895. El cáncer de próstata rara vez se presenta antes de los 50 años. En hombres mayores, el PCa se presenta en la mayoría de los pacientes, pero en la mayoría de los casos es de baja malignidad [2].
La prueba de PSA es la más utilizada para la detección del cáncer de próstata. Mide el antígeno prostático específico (PSA). No es un biomarcador específico para detectar el cáncer de próstata. Es simplemente un indicador de cambios en la próstata. Estos cambios pueden tener muchas causas no relacionadas con el cáncer de próstata (véase la Figura 2).
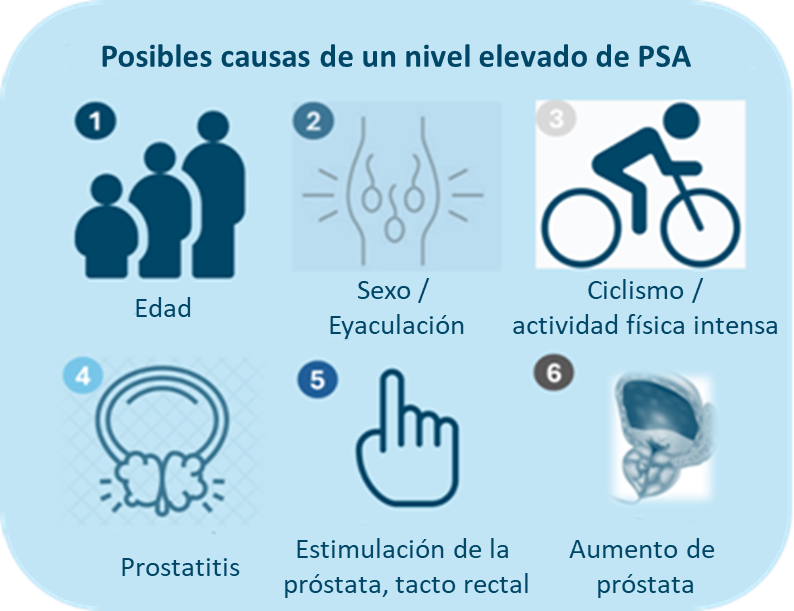
Figura 2: Posibles causas de un nivel elevado de PSA.
Fuentes de error en la evaluación del valor de PSA [11]
- Variaciones intraindividuales: Los valores de PSA pueden fluctuar en +/- 15%.
- Método de medición: Existen variaciones entre laboratorios (hasta aproximadamente un 5%).
- Manipulación de muestras: La manipulación adecuada es crucial, con períodos de estabilidad específicos para las muestras centrifugadas.
- Infección del tracto urinario: Las infecciones pueden causar niveles muy altos de PSA (>100 ng/ml), que pueden tardar hasta un año en normalizarse.
- Retención urinaria aguda: esta condición aumenta moderadamente los niveles de PSA.
- Biopsia: Las pruebas de PSA deben posponerse al menos un mes después de las biopsias.
- Hipogonadismo: la producción de PSA depende de los niveles de testosterona y afecta los niveles de PSA en hombres con niveles bajos de testosterona.
- La producción de antígeno prostático específico depende de los andrógenos y los inhibidores de la 5α-reductasa (p. ej., finasterida, dutasterida), utilizados en la hiperplasia prostática benigna, reducen el nivel de PSA en un 50%.
El dilema del diagnóstico del cáncer de próstata mediante PSA: ¡la causa de biopsias innecesarias y tratamientos excesivos!
La única solución necesaria para la sospecha predominantemente falsa de cáncer basada en niveles elevados de PSA es actualmente la biopsia invasiva, que se asocia a efectos secundarios significativos. Sin embargo, los resultados de la biopsia de próstata suelen arrojar falsos positivos y falsos negativos, lo que en muchos casos conduce a un sobretratamiento: el 90 % de los tratamientos radicales de próstata son innecesarios, lo que conlleva limitaciones significativas (incontinencia/impotencia) y, además, riesgos innecesarios. Los resultados del estudio ProtecT [12], que mostraron sobretratamiento en el 90 % de todos los tratamientos y biopsias, han generado una crisis de confianza entre los pacientes en la medicina en general.
La probabilidad de que las agujas de biopsia no detecten el tumor es alta. Un mayor número de biopsias (hasta 12 agujas se pueden insertar en la próstata en lugar de 6) y la repetición de biopsias se han diseñado para compensar esto. Sin embargo, el mayor número de biopsias y la repetición de biopsias también incrementan exponencialmente los riesgos de inflamación, metástasis tumoral y, por lo tanto, los riesgos para la salud en el diagnóstico del cáncer de próstata.

Figura 3: Árbol de decisión propuesto para un enfoque diagnóstico no invasivo basado en biomarcadores para el cáncer de próstata (PCa). La figura muestra las opciones diagnósticas disponibles. Si no se puede obtener un diagnóstico definitivo ni una recomendación de tratamiento suficientemente fiable, el enfoque diagnóstico invasivo mediante biopsia de próstata sigue siendo la última opción.
Antes de realizar una biopsia de próstata invasiva en un paciente con niveles elevados de PSA, se deben considerar otras opciones no invasivas (véase la Figura 3). Esto debería lograrse cada vez más mediante RMNmp y biopsia por fusión. La RMN tiene una sensibilidad combinada del 91 % y una especificidad combinada del 37 % para el cáncer clínicamente significativo (ISUP ≥GG2) [11]. Esto significa que el 63 % de los pacientes que se someten a una biopsia no presentan cáncer clínicamente significativo.
Otra limitación de la resonancia magnética es que entre el 40 % y el 50 % de los hombres que se someten a una resonancia magnética no obtienen una indicación clara de la presencia de un tumor significativo (PIRADS ≤3). Dado que el resultado es ambiguo y el riesgo de cáncer de próstata significativo es de tan solo el 6 % al 16 %, estos pacientes suelen someterse a una biopsia invasiva [11]. Las compañías de seguros médicos generalmente no cubren los costes de la resonancia magnética previa, que ascienden a aproximadamente 1000 € (hasta 2000 €), solo la biopsia invasiva.
Para corregir los resultados del PSA y la resonancia magnética, las directrices de la EAU recomiendan la estratificación del riesgo utilizando métodos alternativos o biomarcadores para evitar exploraciones por resonancia magnética y procedimientos de biopsia.
El análisis proteómico, con su definición e identificación científica, representa el estado actual del conocimiento médico.
¿Por qué es tan preciso este enfoque metodológico? Las células necesitan renovarse constantemente. Algunas lo hacen rápidamente, otras tardan semanas. Si las señales de regeneración son deficientes, se pueden formar células innecesarias. Si esto no se compensa con los mecanismos integrales del cuerpo, se establecen las llamadas células malignas. Esta es la base para el desarrollo del cáncer, cuyo crecimiento se ve impulsado por procesos inflamatorios en el cuerpo, que también pueden ser causados por el medio ambiente y una cadena alimentaria contaminada. Dado que estos cambios celulares en el cuerpo están controlados exclusivamente por proteínas, el análisis proteómico es el primer método capaz de mapear estas alteraciones. La confirmación en estudios se basa en las limitaciones de enfoques metodológicos como el PSA y la biopsia. Se puede asumir que la precisión del análisis proteómico es incluso cualitativamente mejor que la reportada actualmente. Según los estudios disponibles, el análisis proteómico es extremadamente útil tanto para su detección, con un valor predictivo negativo del 93-94% [13, 14, 15], como para determinar la presencia de un cáncer de próstata peligroso, y debe realizarse después de un hallazgo anormal de PSA antes de realizar diagnósticos o terapias invasivas.
Conclusión
El análisis proteómico no sólo corrige la prueba del PSA en sus hallazgos predominantemente falsos positivos, sino que debido a su enfoque metodológico científico, también es capaz de detectar hallazgos de cáncer graves no detectados previamente.
Referencias
- https://innovation-radar.ec.europa.eu/innovation/58774
- https://www.fda.gov/media/99837/download
- Resolución de la ONU A/RES/66/2 (2011)
- Good et al., Proteómica molecular y celular 2010, 9(11):2424-37.
- Siwy et al., Nephrol Dial Transplant2017, 32(12):2079-2089.
- Mavrogeorgis et al., Nephrol Dial Transplant 28 de febrero de 2024;39(3):453-462.
- Rudnicki et al., Nephrol Dial Transplant2021, 37(1):42-52.
- Jaimes Campos et al.,Pharmaceuticals (Basel)2023, 16(9):1298.
- Instituto Robert Koch, Centro de Datos de Registro de Cáncer, consulta de base de datos con datos hasta 2022.
- Haas y otros, Can J Urol. 2008, 15(1):3866-71.
- Cornford y otros, Eur Urol. 2024, 86(2):148-163.
- Hamdy et al., N Engl J Med. 2023, 388(17):1547-1558.
- Frantzi et al., Br J Cancer. 2019, 120(12):1120-1128.
- Frantzi et al., Mundo J Urol. 2022, 40(9):2195-2203.
- Frantzi et al., Patobiología 2024, 11:1-10.





